Den europeiske OFFICAIR studien omfattet data for opplevd innemiljø i «moderne» kontorbygninger fra 7441 arbeidere i 167 bygg i åtte land. 49% var plaget med «tørr luft (Sakellaris et al 2016). Basert på relativt kortvarige eksperimenter i klimakammer ble tidligere opplevd tørr luft ikke assosiert med luftfuktighet i helt ren luft, men i hovedsak tilskrevet irritasjonseffekter av kombinasjoner av luftforurensning (støv, kjemikalier, formaldehyd, akrolein, oson, nitrogenoksid etc), og høy temperatur (Fanger 2006, Wiik 2011). Bedring kunne oppnås med samme og til og med redusert ventilasjon i kombinasjon med andre tiltak inkludert bedre kildekontroll, luftrensing, personalisert ventilasjon og å levere kald og tørr luft med lav entalpi (energiinnhold) til brukerne (Fanger 2006).
Les også: Nye utfordringer med Covid-19-sykdommen
I feltstudier med lengre eksponeringstid er fornemmelse av dårlig og tørr luft likevel signifikant assosiert med lav relativ fuktighet (RF). Økende RF i området 15-35% ga bedre stabilitet av tårefilmen og fornemmelse av tørrhet ble redusert (Bakke et al 2008). Hyppigheten av «tørr luft» ble mer enn doblet fra cellekontor til åpent kontorlandskap, øye- og neseirritasjon ble doblet (Pejtersen et al 2006). Han konkluderte: «Det ser ut til at opplevd tørr luft er noe annet enn fuktighet og det er nødvendig å validere dette spørsmålet. I oppvarmingssesongen var fornemmelse av «tørr luft» viktigste enkeltfaktor forbundet med redusert produktivitet (Wiik 2011). En nylig review konkluderer med at økt RF kan redusere plagefrekvens og fremme produktivitet i kontor sammenlignet med tørre forhold (Wolkoff 2018). Selv lett forhøyet fuktighet kan være gunstig og lindre øyeplagene.
Influensasykdom og tørr inneluft
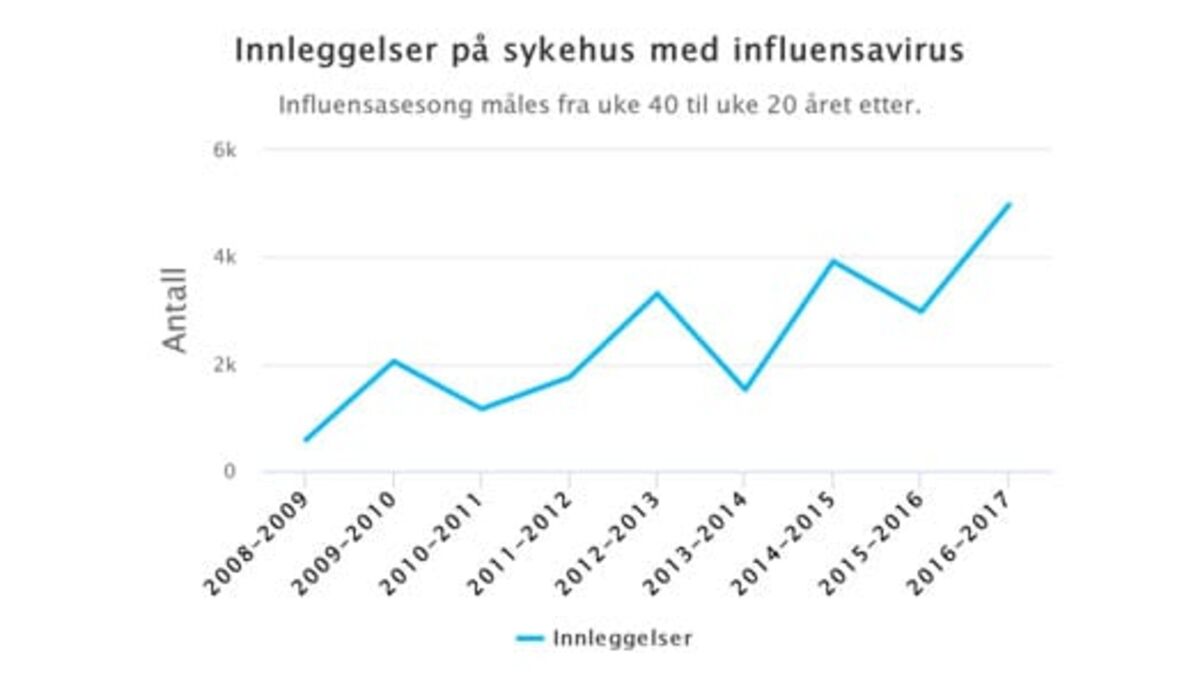
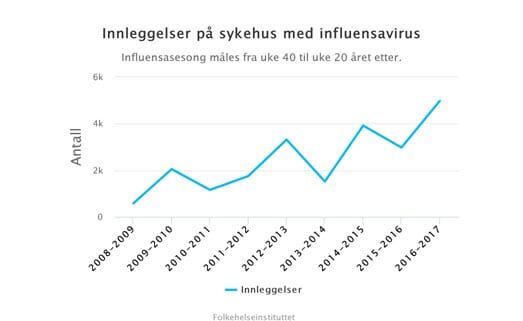 Figur 1. (Folkehelsa/NRK). Rundt 100.000 får influensa-diagnosen hvert år, og flere legges inn på norske sykehus som følge av influensaviruse (Hauge et al. 2019). I sesongene 2008/9 til 2016/17 var i gjennomsnitt 2500 hospitalisert for influensa. Antallet varierte fra 579 i 2008/09 til 4973 i 2016/17. Majoriteten av dødsfall på sykehus var hos pasienter 70 år og eldre.
På våre breddegrader kommer influensasesongen om vinteren. Når det er kaldt ute synker det absolutte innholdet (AH) av vann i uteluft, selv om relativ luftfuktighet RF% kan være høy. Maksimalt vanninnhold i luft synker med temperaturen. Ved kuldegrader er det svært lavt. RF% angir prosentandelen fuktighet av maksimalt vanninnhold i lufta ved den aktuelle temperaturen. Når temperaturen synker ved 100% RF vil vanninnholdet kondensere. Når uteluft varmes opp igjen inne synker derfor RF%.
Virussmitte i innemiljø er hyppig årsak til infeksjonssykdommer siden de så lett kan spres, særlig i overbefolkede og tettbodde innemiljø med dårlig ventilasjon (La Rosa et al 2013). Influensapandemien 1918, «spanskesyken» var usedvanlig virulent (sykdomsskapende) og drepte mer enn 50 millioner mennesker globalt, mer enn fem ganger de samlede tapene i første verdenskrig. Overbefolkning av boliger (tettboddhet) fremstod som viktigste medvirkende faktor. Det tidoblet smitterisiko for influensa og femdoblet risiko for lungebetennelse (Aligne 2016). I Norge mistet 13-15 000 mennesker livet (Borza 2001). I tillegg til spanskesyken ble vi senere også rammet av pandemiene Asiasyken 1957, Hong Kong-syken 1968 og Svineinfluensa 2009.
En typisk influensasesong i USA gir ca 200 000 sykehusinnleggelser og 36 000 dødsfall (Metz & Finn 2016). Globalt gir influensa A tre til fem millioner av alvorlig influensa og 250 000 500 000 døde. Ifølge Folkehelseinstituttet 2017 blir vanligvis 5-10% av befolkningen i Norge syke med en gjennomsnittlig overdødelighet på ca 900/personer/år.
Infeksjoner av influensavirus er blant de vanligste og svært smittsomme sykdommene som rammer alle aldersgrupper og medfører alle alvorlighetsgrader fra lett trøtthet til respirasjonssvikt og død (La Rosa et al 2013). Rundt 50% av alle infeksjoner kan være asymptomatiske, men kan likevel spre virus og utgjøre et reservoar av smitte. I de fleste tilfeller overføres influensaviruset med dråper, gjennom hoste og nysing av smittede personer, men det kan også overføres av luftbårne dråpekjerner samt ved kontakt, enten gjennom direkte hud-til-hud eller indirekte ved kontakt med forurensede flater.
Influensavirus er påvist i flere ulike innemiljø som boliger, skoler og kontorbygg (La Rosa et al 2013). Offentlige steder som sykehus og andre institusjoner, med mange sårbare personer, ofte kombinert med høy befolkningstetthet, kan ha høye konsentrasjoner av patogener (sykdomsfremkallende agens som virus) og derfor utgjøre en betydelig risiko for smitte med potensielt dødelige konsekvenser for pasientene (Salgado et al 2002, Stott et al 2002, Wong et al 2010).
Ved lav luftfuktighet kan influensa A overleve lenge i aerosoler, spres videre og gi hele spekteret av sykdom ved doser som er mye mindre enn de som kreves ved eksperimentell dråpesmitte i nesen (store dråper). Smitteoverføring av influensa med tørre aerosoler kan blokkeres gjennom UV-bestråling av øvre del av romlufta (Tellier 2006, 2009, Blachere et al 2009, Fabian et al 2008, La Rosa et al 2013).
Figur 1. (Folkehelsa/NRK). Rundt 100.000 får influensa-diagnosen hvert år, og flere legges inn på norske sykehus som følge av influensaviruse (Hauge et al. 2019). I sesongene 2008/9 til 2016/17 var i gjennomsnitt 2500 hospitalisert for influensa. Antallet varierte fra 579 i 2008/09 til 4973 i 2016/17. Majoriteten av dødsfall på sykehus var hos pasienter 70 år og eldre.
På våre breddegrader kommer influensasesongen om vinteren. Når det er kaldt ute synker det absolutte innholdet (AH) av vann i uteluft, selv om relativ luftfuktighet RF% kan være høy. Maksimalt vanninnhold i luft synker med temperaturen. Ved kuldegrader er det svært lavt. RF% angir prosentandelen fuktighet av maksimalt vanninnhold i lufta ved den aktuelle temperaturen. Når temperaturen synker ved 100% RF vil vanninnholdet kondensere. Når uteluft varmes opp igjen inne synker derfor RF%.
Virussmitte i innemiljø er hyppig årsak til infeksjonssykdommer siden de så lett kan spres, særlig i overbefolkede og tettbodde innemiljø med dårlig ventilasjon (La Rosa et al 2013). Influensapandemien 1918, «spanskesyken» var usedvanlig virulent (sykdomsskapende) og drepte mer enn 50 millioner mennesker globalt, mer enn fem ganger de samlede tapene i første verdenskrig. Overbefolkning av boliger (tettboddhet) fremstod som viktigste medvirkende faktor. Det tidoblet smitterisiko for influensa og femdoblet risiko for lungebetennelse (Aligne 2016). I Norge mistet 13-15 000 mennesker livet (Borza 2001). I tillegg til spanskesyken ble vi senere også rammet av pandemiene Asiasyken 1957, Hong Kong-syken 1968 og Svineinfluensa 2009.
En typisk influensasesong i USA gir ca 200 000 sykehusinnleggelser og 36 000 dødsfall (Metz & Finn 2016). Globalt gir influensa A tre til fem millioner av alvorlig influensa og 250 000 500 000 døde. Ifølge Folkehelseinstituttet 2017 blir vanligvis 5-10% av befolkningen i Norge syke med en gjennomsnittlig overdødelighet på ca 900/personer/år.
Infeksjoner av influensavirus er blant de vanligste og svært smittsomme sykdommene som rammer alle aldersgrupper og medfører alle alvorlighetsgrader fra lett trøtthet til respirasjonssvikt og død (La Rosa et al 2013). Rundt 50% av alle infeksjoner kan være asymptomatiske, men kan likevel spre virus og utgjøre et reservoar av smitte. I de fleste tilfeller overføres influensaviruset med dråper, gjennom hoste og nysing av smittede personer, men det kan også overføres av luftbårne dråpekjerner samt ved kontakt, enten gjennom direkte hud-til-hud eller indirekte ved kontakt med forurensede flater.
Influensavirus er påvist i flere ulike innemiljø som boliger, skoler og kontorbygg (La Rosa et al 2013). Offentlige steder som sykehus og andre institusjoner, med mange sårbare personer, ofte kombinert med høy befolkningstetthet, kan ha høye konsentrasjoner av patogener (sykdomsfremkallende agens som virus) og derfor utgjøre en betydelig risiko for smitte med potensielt dødelige konsekvenser for pasientene (Salgado et al 2002, Stott et al 2002, Wong et al 2010).
Ved lav luftfuktighet kan influensa A overleve lenge i aerosoler, spres videre og gi hele spekteret av sykdom ved doser som er mye mindre enn de som kreves ved eksperimentell dråpesmitte i nesen (store dråper). Smitteoverføring av influensa med tørre aerosoler kan blokkeres gjennom UV-bestråling av øvre del av romlufta (Tellier 2006, 2009, Blachere et al 2009, Fabian et al 2008, La Rosa et al 2013).
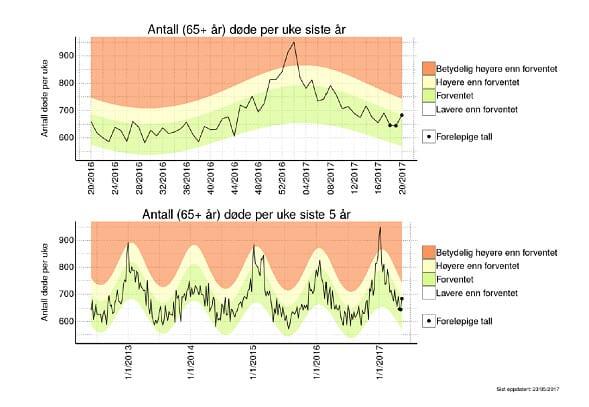 Figur 2.Totalt antall døde i Norge per uke siste år og siste 5 år i aldersgruppen fra 65 år og eldre. Folkehelseinstituttet 2017 Influensasesongen i Norge 2016-17. Vanligvis blir 5-10% av befolkningen syke. Overdødelighet ca 900/år. I 2016-17 var det betydelig overdødelighet uke 50/2016 - uke 3/2017 og uke 5 og uke 8/2017. Dette skyldtes hovedsakelig et høyere antall dødsfall enn forventet hos eldre over 65 år.
Shaman et al 2009 kunne vise at lav absolutt fuktighet i luft (AH) var det beste målet for influensa overlevelse, spredning og sesongsprevalens av sykdom. Gjennom datasimuleringer kunne de vise at 31 års gjennomsnitt overhyppighet av lungebetennelse og mortalitet av influensa svingte parallelt med absolutt fuktighet (figur 3) og sesong.
Figur 2.Totalt antall døde i Norge per uke siste år og siste 5 år i aldersgruppen fra 65 år og eldre. Folkehelseinstituttet 2017 Influensasesongen i Norge 2016-17. Vanligvis blir 5-10% av befolkningen syke. Overdødelighet ca 900/år. I 2016-17 var det betydelig overdødelighet uke 50/2016 - uke 3/2017 og uke 5 og uke 8/2017. Dette skyldtes hovedsakelig et høyere antall dødsfall enn forventet hos eldre over 65 år.
Shaman et al 2009 kunne vise at lav absolutt fuktighet i luft (AH) var det beste målet for influensa overlevelse, spredning og sesongsprevalens av sykdom. Gjennom datasimuleringer kunne de vise at 31 års gjennomsnitt overhyppighet av lungebetennelse og mortalitet av influensa svingte parallelt med absolutt fuktighet (figur 3) og sesong.
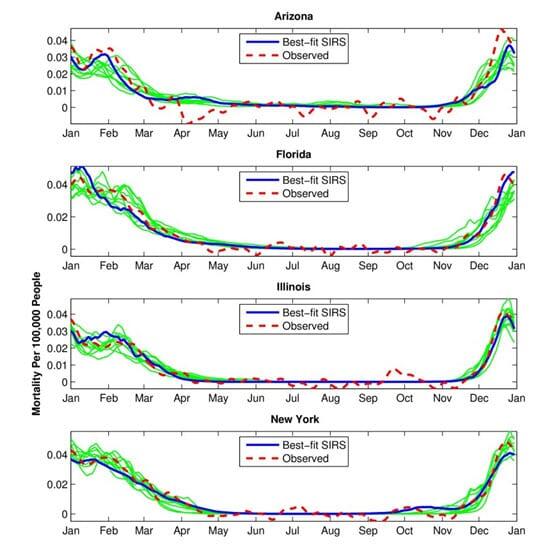
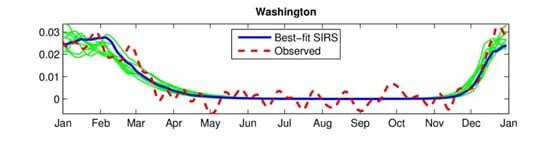 Figur 3. Shaman & Kohn 2009: Mean annual cycles for the best-fit SIRS (susceptible, infected, recovered, simulation) model simulations at the 5 state sites. Here, best-fit simulations were selected individually for each state based on RMS error after scaling the 31-year mean daily infection number to the 31-year mean observed daily excess P&I mortality rate. Thick blue line shows the best-fit simulation; thinner green lines show the next 9 best simulations.
Data for meteorologi og influensaepidemiologi fra 49 prefekturer i Japan 1991 95 og 1999-2009 ga 2392 sett av ukentlige innsamlede data for hver av de 15 sesongene (Shoji et al 2011). Influensaepidemien startet etter lav absolutt fuktighet (AH) i uteluft, og gikk over eller tilbake etter høy AH i uteluft. Årsak til lav AH i uteluft er stort sett knyttet til lave utetemperaturer med påfølgende fall av AH inne som igjen gir fall av RF% avhengig av temperaturdifferanse, ventilasjonsrate og fuktkilder inne.
Tilsvarende funn er gjort av andre (Tsuchihashi et al 2011, Davis et al 2012, Jaakkola et al 2014). Basert på en studie av 892 vernepliktige konkluderer Jaakkola et al 2014 at i kaldt klima er det heller et fall, enn utendørs lav temperatur og fuktighet (AH) i seg selv, som forutgår de tre dagene med inkubasjonstid før influensaepisodene (figur 4 og 5).
I en svensk studie gjennom fire sesonger mellom oktober 2010 og Juli 2013 ble 20062 nese/hals-prøver samlet for PCR-identifisering av luftveis-patogener (Sundell et al 2016). Lav utetemperatur og -AH var assosiert med ukentlig insidens av IFA (influensa A), RS-virus, metapneumovirus, bocavirus og adenovirus mens insidens av humant rinovirus og enterovirus var uavhengig av temperatur. Under sesongsutbrudd av IFA var ukentlige fall av gjennomsnittstemperatur sterk assosiert med IFA-insidens uka etter (Figur 6-8).
Det var markert sesongs-preg for flere luftveisvirus (Sundell et al 2016). Fall i utetemperatur og damptrykk (AH) kommer før inkubasjonstiden for de årlige influensaepidemiene. Humant rhino- og enterovirus synes uavhengig av klimatiske forhold.
Figur 3. Shaman & Kohn 2009: Mean annual cycles for the best-fit SIRS (susceptible, infected, recovered, simulation) model simulations at the 5 state sites. Here, best-fit simulations were selected individually for each state based on RMS error after scaling the 31-year mean daily infection number to the 31-year mean observed daily excess P&I mortality rate. Thick blue line shows the best-fit simulation; thinner green lines show the next 9 best simulations.
Data for meteorologi og influensaepidemiologi fra 49 prefekturer i Japan 1991 95 og 1999-2009 ga 2392 sett av ukentlige innsamlede data for hver av de 15 sesongene (Shoji et al 2011). Influensaepidemien startet etter lav absolutt fuktighet (AH) i uteluft, og gikk over eller tilbake etter høy AH i uteluft. Årsak til lav AH i uteluft er stort sett knyttet til lave utetemperaturer med påfølgende fall av AH inne som igjen gir fall av RF% avhengig av temperaturdifferanse, ventilasjonsrate og fuktkilder inne.
Tilsvarende funn er gjort av andre (Tsuchihashi et al 2011, Davis et al 2012, Jaakkola et al 2014). Basert på en studie av 892 vernepliktige konkluderer Jaakkola et al 2014 at i kaldt klima er det heller et fall, enn utendørs lav temperatur og fuktighet (AH) i seg selv, som forutgår de tre dagene med inkubasjonstid før influensaepisodene (figur 4 og 5).
I en svensk studie gjennom fire sesonger mellom oktober 2010 og Juli 2013 ble 20062 nese/hals-prøver samlet for PCR-identifisering av luftveis-patogener (Sundell et al 2016). Lav utetemperatur og -AH var assosiert med ukentlig insidens av IFA (influensa A), RS-virus, metapneumovirus, bocavirus og adenovirus mens insidens av humant rinovirus og enterovirus var uavhengig av temperatur. Under sesongsutbrudd av IFA var ukentlige fall av gjennomsnittstemperatur sterk assosiert med IFA-insidens uka etter (Figur 6-8).
Det var markert sesongs-preg for flere luftveisvirus (Sundell et al 2016). Fall i utetemperatur og damptrykk (AH) kommer før inkubasjonstiden for de årlige influensaepidemiene. Humant rhino- og enterovirus synes uavhengig av klimatiske forhold.
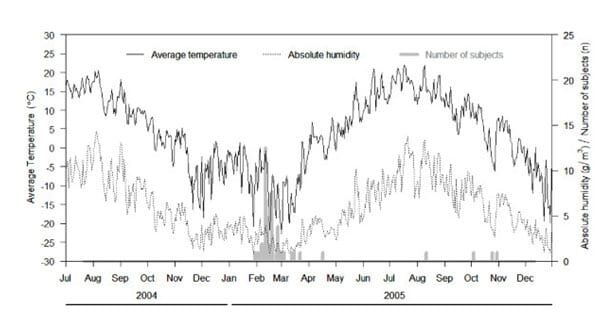 Figur 4, (Jaakkola et al 2014). Incidence of influenza episodes, mean daily temperature (°C) and mean daily absolute humidity (AH) (g/m3 ) during the study period.
Figur 4, (Jaakkola et al 2014). Incidence of influenza episodes, mean daily temperature (°C) and mean daily absolute humidity (AH) (g/m3 ) during the study period.
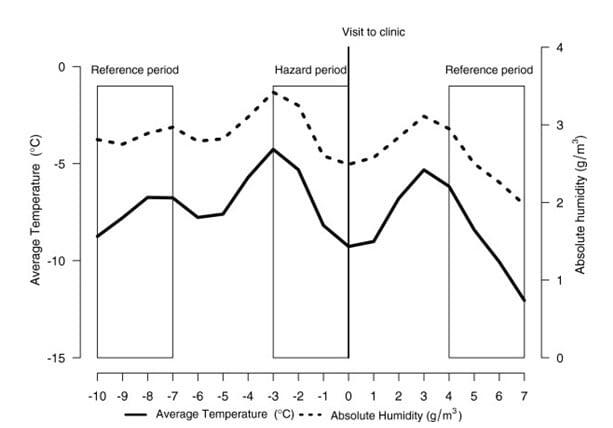 Figur 5, (Jaakkola et al 2014). Mean daily temperature (°C) and absolute humidity (g/m3) during the hazard and reference periods starting 7 days before and after the beginning of the hazard period. Values represent means of the observed cases of influenza (n?=?66). For the logistic regression analyses the mean temperature and AH was calculated from the three preceding days (day-3 to 0) of the onset of an influenza infection and similarly for the reference periods 7 days before and after the infection. A maximum decline in temperature and AH was calculated as the largest change (maximum versus minimum) occurring in these parameters within the three-day period (e.g. day ?3 versus day ?2, day ?3 versus day ?1, day ?2 versus day ?1 etc.) and similarly for the reference periods.
Figur 5, (Jaakkola et al 2014). Mean daily temperature (°C) and absolute humidity (g/m3) during the hazard and reference periods starting 7 days before and after the beginning of the hazard period. Values represent means of the observed cases of influenza (n?=?66). For the logistic regression analyses the mean temperature and AH was calculated from the three preceding days (day-3 to 0) of the onset of an influenza infection and similarly for the reference periods 7 days before and after the infection. A maximum decline in temperature and AH was calculated as the largest change (maximum versus minimum) occurring in these parameters within the three-day period (e.g. day ?3 versus day ?2, day ?3 versus day ?1, day ?2 versus day ?1 etc.) and similarly for the reference periods.
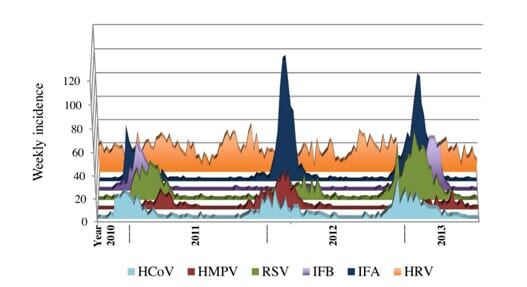 Figur 6. (Sundell et al 2016). Weekly incidence of various respiratory pathogens, detected with real-time PCR, according to season across three consecutive years 20102013 (n = 8006). All agents except human rhinovirus have a strong seasonal pattern with outbreak occurring during wintertime and almost no activity during summer.
Figur 6. (Sundell et al 2016). Weekly incidence of various respiratory pathogens, detected with real-time PCR, according to season across three consecutive years 20102013 (n = 8006). All agents except human rhinovirus have a strong seasonal pattern with outbreak occurring during wintertime and almost no activity during summer.
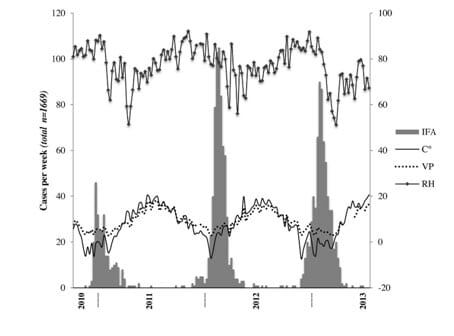 Figur 7 (Sundell et al 2016). Weekly incidence (number of cases/week) of influenza A (IFA) virus infections (grey bars) according to average weekly outdoor temperature (degrees Celsius; solid black line), vapor pressure (VP (hPa); dotted black line) and relative humidity (RH (%); squared black line) across the entire study period (October 2010July 2013).
Figur 7 (Sundell et al 2016). Weekly incidence (number of cases/week) of influenza A (IFA) virus infections (grey bars) according to average weekly outdoor temperature (degrees Celsius; solid black line), vapor pressure (VP (hPa); dotted black line) and relative humidity (RH (%); squared black line) across the entire study period (October 2010July 2013).
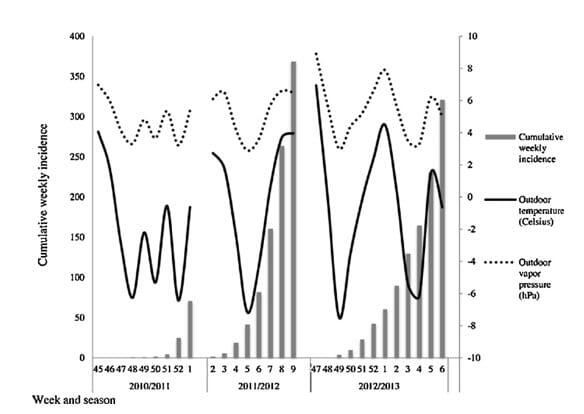 Figur 8 (Sundell et al 2016). Cumulative weekly incidence of influenza A (IFA) virus infections (number of cases per week; grey bars) according to average weekly outdoor temperature (degrees Celsius; solid grey line) and vapor pressure (dotted black line) during each of the three seasonal IFA outbreaks that occurred during the study period, separately.
Veien videre
Sykehusene anses som verstingen med hensyn til «tørr luft» med jevnt over svært høye ventilasjonsrater og for høye lufttemperaturer kombinert med dels opphopning av svært sårbare pasientgrupper.
Det foreslås å befukte opp til 30-40% RF for å forebygge influensasmitte (både økt smitteevne, virulens og mottakelighet hos sårbare grupper) både i vitenskapelig litteratur (Arundel et al 1985, Shaman & Kohn 2009, Davis et al 2012, Metz et al 2015) og av leverandører av befuktingsinstallasjoner. Dette blir brukt for det det er verdt i markedsføringen av «gode løsninger». Ulempene er at:
Figur 8 (Sundell et al 2016). Cumulative weekly incidence of influenza A (IFA) virus infections (number of cases per week; grey bars) according to average weekly outdoor temperature (degrees Celsius; solid grey line) and vapor pressure (dotted black line) during each of the three seasonal IFA outbreaks that occurred during the study period, separately.
Veien videre
Sykehusene anses som verstingen med hensyn til «tørr luft» med jevnt over svært høye ventilasjonsrater og for høye lufttemperaturer kombinert med dels opphopning av svært sårbare pasientgrupper.
Det foreslås å befukte opp til 30-40% RF for å forebygge influensasmitte (både økt smitteevne, virulens og mottakelighet hos sårbare grupper) både i vitenskapelig litteratur (Arundel et al 1985, Shaman & Kohn 2009, Davis et al 2012, Metz et al 2015) og av leverandører av befuktingsinstallasjoner. Dette blir brukt for det det er verdt i markedsføringen av «gode løsninger». Ulempene er at:
 Figur 1. (Folkehelsa/NRK). Rundt 100.000 får influensa-diagnosen hvert år, og flere legges inn på norske sykehus som følge av influensaviruse (Hauge et al. 2019). I sesongene 2008/9 til 2016/17 var i gjennomsnitt 2500 hospitalisert for influensa. Antallet varierte fra 579 i 2008/09 til 4973 i 2016/17. Majoriteten av dødsfall på sykehus var hos pasienter 70 år og eldre.
På våre breddegrader kommer influensasesongen om vinteren. Når det er kaldt ute synker det absolutte innholdet (AH) av vann i uteluft, selv om relativ luftfuktighet RF% kan være høy. Maksimalt vanninnhold i luft synker med temperaturen. Ved kuldegrader er det svært lavt. RF% angir prosentandelen fuktighet av maksimalt vanninnhold i lufta ved den aktuelle temperaturen. Når temperaturen synker ved 100% RF vil vanninnholdet kondensere. Når uteluft varmes opp igjen inne synker derfor RF%.
Virussmitte i innemiljø er hyppig årsak til infeksjonssykdommer siden de så lett kan spres, særlig i overbefolkede og tettbodde innemiljø med dårlig ventilasjon (La Rosa et al 2013). Influensapandemien 1918, «spanskesyken» var usedvanlig virulent (sykdomsskapende) og drepte mer enn 50 millioner mennesker globalt, mer enn fem ganger de samlede tapene i første verdenskrig. Overbefolkning av boliger (tettboddhet) fremstod som viktigste medvirkende faktor. Det tidoblet smitterisiko for influensa og femdoblet risiko for lungebetennelse (Aligne 2016). I Norge mistet 13-15 000 mennesker livet (Borza 2001). I tillegg til spanskesyken ble vi senere også rammet av pandemiene Asiasyken 1957, Hong Kong-syken 1968 og Svineinfluensa 2009.
En typisk influensasesong i USA gir ca 200 000 sykehusinnleggelser og 36 000 dødsfall (Metz & Finn 2016). Globalt gir influensa A tre til fem millioner av alvorlig influensa og 250 000 500 000 døde. Ifølge Folkehelseinstituttet 2017 blir vanligvis 5-10% av befolkningen i Norge syke med en gjennomsnittlig overdødelighet på ca 900/personer/år.
Infeksjoner av influensavirus er blant de vanligste og svært smittsomme sykdommene som rammer alle aldersgrupper og medfører alle alvorlighetsgrader fra lett trøtthet til respirasjonssvikt og død (La Rosa et al 2013). Rundt 50% av alle infeksjoner kan være asymptomatiske, men kan likevel spre virus og utgjøre et reservoar av smitte. I de fleste tilfeller overføres influensaviruset med dråper, gjennom hoste og nysing av smittede personer, men det kan også overføres av luftbårne dråpekjerner samt ved kontakt, enten gjennom direkte hud-til-hud eller indirekte ved kontakt med forurensede flater.
Influensavirus er påvist i flere ulike innemiljø som boliger, skoler og kontorbygg (La Rosa et al 2013). Offentlige steder som sykehus og andre institusjoner, med mange sårbare personer, ofte kombinert med høy befolkningstetthet, kan ha høye konsentrasjoner av patogener (sykdomsfremkallende agens som virus) og derfor utgjøre en betydelig risiko for smitte med potensielt dødelige konsekvenser for pasientene (Salgado et al 2002, Stott et al 2002, Wong et al 2010).
Ved lav luftfuktighet kan influensa A overleve lenge i aerosoler, spres videre og gi hele spekteret av sykdom ved doser som er mye mindre enn de som kreves ved eksperimentell dråpesmitte i nesen (store dråper). Smitteoverføring av influensa med tørre aerosoler kan blokkeres gjennom UV-bestråling av øvre del av romlufta (Tellier 2006, 2009, Blachere et al 2009, Fabian et al 2008, La Rosa et al 2013).
Figur 1. (Folkehelsa/NRK). Rundt 100.000 får influensa-diagnosen hvert år, og flere legges inn på norske sykehus som følge av influensaviruse (Hauge et al. 2019). I sesongene 2008/9 til 2016/17 var i gjennomsnitt 2500 hospitalisert for influensa. Antallet varierte fra 579 i 2008/09 til 4973 i 2016/17. Majoriteten av dødsfall på sykehus var hos pasienter 70 år og eldre.
På våre breddegrader kommer influensasesongen om vinteren. Når det er kaldt ute synker det absolutte innholdet (AH) av vann i uteluft, selv om relativ luftfuktighet RF% kan være høy. Maksimalt vanninnhold i luft synker med temperaturen. Ved kuldegrader er det svært lavt. RF% angir prosentandelen fuktighet av maksimalt vanninnhold i lufta ved den aktuelle temperaturen. Når temperaturen synker ved 100% RF vil vanninnholdet kondensere. Når uteluft varmes opp igjen inne synker derfor RF%.
Virussmitte i innemiljø er hyppig årsak til infeksjonssykdommer siden de så lett kan spres, særlig i overbefolkede og tettbodde innemiljø med dårlig ventilasjon (La Rosa et al 2013). Influensapandemien 1918, «spanskesyken» var usedvanlig virulent (sykdomsskapende) og drepte mer enn 50 millioner mennesker globalt, mer enn fem ganger de samlede tapene i første verdenskrig. Overbefolkning av boliger (tettboddhet) fremstod som viktigste medvirkende faktor. Det tidoblet smitterisiko for influensa og femdoblet risiko for lungebetennelse (Aligne 2016). I Norge mistet 13-15 000 mennesker livet (Borza 2001). I tillegg til spanskesyken ble vi senere også rammet av pandemiene Asiasyken 1957, Hong Kong-syken 1968 og Svineinfluensa 2009.
En typisk influensasesong i USA gir ca 200 000 sykehusinnleggelser og 36 000 dødsfall (Metz & Finn 2016). Globalt gir influensa A tre til fem millioner av alvorlig influensa og 250 000 500 000 døde. Ifølge Folkehelseinstituttet 2017 blir vanligvis 5-10% av befolkningen i Norge syke med en gjennomsnittlig overdødelighet på ca 900/personer/år.
Infeksjoner av influensavirus er blant de vanligste og svært smittsomme sykdommene som rammer alle aldersgrupper og medfører alle alvorlighetsgrader fra lett trøtthet til respirasjonssvikt og død (La Rosa et al 2013). Rundt 50% av alle infeksjoner kan være asymptomatiske, men kan likevel spre virus og utgjøre et reservoar av smitte. I de fleste tilfeller overføres influensaviruset med dråper, gjennom hoste og nysing av smittede personer, men det kan også overføres av luftbårne dråpekjerner samt ved kontakt, enten gjennom direkte hud-til-hud eller indirekte ved kontakt med forurensede flater.
Influensavirus er påvist i flere ulike innemiljø som boliger, skoler og kontorbygg (La Rosa et al 2013). Offentlige steder som sykehus og andre institusjoner, med mange sårbare personer, ofte kombinert med høy befolkningstetthet, kan ha høye konsentrasjoner av patogener (sykdomsfremkallende agens som virus) og derfor utgjøre en betydelig risiko for smitte med potensielt dødelige konsekvenser for pasientene (Salgado et al 2002, Stott et al 2002, Wong et al 2010).
Ved lav luftfuktighet kan influensa A overleve lenge i aerosoler, spres videre og gi hele spekteret av sykdom ved doser som er mye mindre enn de som kreves ved eksperimentell dråpesmitte i nesen (store dråper). Smitteoverføring av influensa med tørre aerosoler kan blokkeres gjennom UV-bestråling av øvre del av romlufta (Tellier 2006, 2009, Blachere et al 2009, Fabian et al 2008, La Rosa et al 2013).

 Figur 2.Totalt antall døde i Norge per uke siste år og siste 5 år i aldersgruppen fra 65 år og eldre. Folkehelseinstituttet 2017 Influensasesongen i Norge 2016-17. Vanligvis blir 5-10% av befolkningen syke. Overdødelighet ca 900/år. I 2016-17 var det betydelig overdødelighet uke 50/2016 - uke 3/2017 og uke 5 og uke 8/2017. Dette skyldtes hovedsakelig et høyere antall dødsfall enn forventet hos eldre over 65 år.
Shaman et al 2009 kunne vise at lav absolutt fuktighet i luft (AH) var det beste målet for influensa overlevelse, spredning og sesongsprevalens av sykdom. Gjennom datasimuleringer kunne de vise at 31 års gjennomsnitt overhyppighet av lungebetennelse og mortalitet av influensa svingte parallelt med absolutt fuktighet (figur 3) og sesong.
Figur 2.Totalt antall døde i Norge per uke siste år og siste 5 år i aldersgruppen fra 65 år og eldre. Folkehelseinstituttet 2017 Influensasesongen i Norge 2016-17. Vanligvis blir 5-10% av befolkningen syke. Overdødelighet ca 900/år. I 2016-17 var det betydelig overdødelighet uke 50/2016 - uke 3/2017 og uke 5 og uke 8/2017. Dette skyldtes hovedsakelig et høyere antall dødsfall enn forventet hos eldre over 65 år.
Shaman et al 2009 kunne vise at lav absolutt fuktighet i luft (AH) var det beste målet for influensa overlevelse, spredning og sesongsprevalens av sykdom. Gjennom datasimuleringer kunne de vise at 31 års gjennomsnitt overhyppighet av lungebetennelse og mortalitet av influensa svingte parallelt med absolutt fuktighet (figur 3) og sesong.

 Figur 3. Shaman & Kohn 2009: Mean annual cycles for the best-fit SIRS (susceptible, infected, recovered, simulation) model simulations at the 5 state sites. Here, best-fit simulations were selected individually for each state based on RMS error after scaling the 31-year mean daily infection number to the 31-year mean observed daily excess P&I mortality rate. Thick blue line shows the best-fit simulation; thinner green lines show the next 9 best simulations.
Data for meteorologi og influensaepidemiologi fra 49 prefekturer i Japan 1991 95 og 1999-2009 ga 2392 sett av ukentlige innsamlede data for hver av de 15 sesongene (Shoji et al 2011). Influensaepidemien startet etter lav absolutt fuktighet (AH) i uteluft, og gikk over eller tilbake etter høy AH i uteluft. Årsak til lav AH i uteluft er stort sett knyttet til lave utetemperaturer med påfølgende fall av AH inne som igjen gir fall av RF% avhengig av temperaturdifferanse, ventilasjonsrate og fuktkilder inne.
Tilsvarende funn er gjort av andre (Tsuchihashi et al 2011, Davis et al 2012, Jaakkola et al 2014). Basert på en studie av 892 vernepliktige konkluderer Jaakkola et al 2014 at i kaldt klima er det heller et fall, enn utendørs lav temperatur og fuktighet (AH) i seg selv, som forutgår de tre dagene med inkubasjonstid før influensaepisodene (figur 4 og 5).
I en svensk studie gjennom fire sesonger mellom oktober 2010 og Juli 2013 ble 20062 nese/hals-prøver samlet for PCR-identifisering av luftveis-patogener (Sundell et al 2016). Lav utetemperatur og -AH var assosiert med ukentlig insidens av IFA (influensa A), RS-virus, metapneumovirus, bocavirus og adenovirus mens insidens av humant rinovirus og enterovirus var uavhengig av temperatur. Under sesongsutbrudd av IFA var ukentlige fall av gjennomsnittstemperatur sterk assosiert med IFA-insidens uka etter (Figur 6-8).
Det var markert sesongs-preg for flere luftveisvirus (Sundell et al 2016). Fall i utetemperatur og damptrykk (AH) kommer før inkubasjonstiden for de årlige influensaepidemiene. Humant rhino- og enterovirus synes uavhengig av klimatiske forhold.
Figur 3. Shaman & Kohn 2009: Mean annual cycles for the best-fit SIRS (susceptible, infected, recovered, simulation) model simulations at the 5 state sites. Here, best-fit simulations were selected individually for each state based on RMS error after scaling the 31-year mean daily infection number to the 31-year mean observed daily excess P&I mortality rate. Thick blue line shows the best-fit simulation; thinner green lines show the next 9 best simulations.
Data for meteorologi og influensaepidemiologi fra 49 prefekturer i Japan 1991 95 og 1999-2009 ga 2392 sett av ukentlige innsamlede data for hver av de 15 sesongene (Shoji et al 2011). Influensaepidemien startet etter lav absolutt fuktighet (AH) i uteluft, og gikk over eller tilbake etter høy AH i uteluft. Årsak til lav AH i uteluft er stort sett knyttet til lave utetemperaturer med påfølgende fall av AH inne som igjen gir fall av RF% avhengig av temperaturdifferanse, ventilasjonsrate og fuktkilder inne.
Tilsvarende funn er gjort av andre (Tsuchihashi et al 2011, Davis et al 2012, Jaakkola et al 2014). Basert på en studie av 892 vernepliktige konkluderer Jaakkola et al 2014 at i kaldt klima er det heller et fall, enn utendørs lav temperatur og fuktighet (AH) i seg selv, som forutgår de tre dagene med inkubasjonstid før influensaepisodene (figur 4 og 5).
I en svensk studie gjennom fire sesonger mellom oktober 2010 og Juli 2013 ble 20062 nese/hals-prøver samlet for PCR-identifisering av luftveis-patogener (Sundell et al 2016). Lav utetemperatur og -AH var assosiert med ukentlig insidens av IFA (influensa A), RS-virus, metapneumovirus, bocavirus og adenovirus mens insidens av humant rinovirus og enterovirus var uavhengig av temperatur. Under sesongsutbrudd av IFA var ukentlige fall av gjennomsnittstemperatur sterk assosiert med IFA-insidens uka etter (Figur 6-8).
Det var markert sesongs-preg for flere luftveisvirus (Sundell et al 2016). Fall i utetemperatur og damptrykk (AH) kommer før inkubasjonstiden for de årlige influensaepidemiene. Humant rhino- og enterovirus synes uavhengig av klimatiske forhold.
 Figur 4, (Jaakkola et al 2014). Incidence of influenza episodes, mean daily temperature (°C) and mean daily absolute humidity (AH) (g/m3 ) during the study period.
Figur 4, (Jaakkola et al 2014). Incidence of influenza episodes, mean daily temperature (°C) and mean daily absolute humidity (AH) (g/m3 ) during the study period.
 Figur 5, (Jaakkola et al 2014). Mean daily temperature (°C) and absolute humidity (g/m3) during the hazard and reference periods starting 7 days before and after the beginning of the hazard period. Values represent means of the observed cases of influenza (n?=?66). For the logistic regression analyses the mean temperature and AH was calculated from the three preceding days (day-3 to 0) of the onset of an influenza infection and similarly for the reference periods 7 days before and after the infection. A maximum decline in temperature and AH was calculated as the largest change (maximum versus minimum) occurring in these parameters within the three-day period (e.g. day ?3 versus day ?2, day ?3 versus day ?1, day ?2 versus day ?1 etc.) and similarly for the reference periods.
Figur 5, (Jaakkola et al 2014). Mean daily temperature (°C) and absolute humidity (g/m3) during the hazard and reference periods starting 7 days before and after the beginning of the hazard period. Values represent means of the observed cases of influenza (n?=?66). For the logistic regression analyses the mean temperature and AH was calculated from the three preceding days (day-3 to 0) of the onset of an influenza infection and similarly for the reference periods 7 days before and after the infection. A maximum decline in temperature and AH was calculated as the largest change (maximum versus minimum) occurring in these parameters within the three-day period (e.g. day ?3 versus day ?2, day ?3 versus day ?1, day ?2 versus day ?1 etc.) and similarly for the reference periods.
 Figur 6. (Sundell et al 2016). Weekly incidence of various respiratory pathogens, detected with real-time PCR, according to season across three consecutive years 20102013 (n = 8006). All agents except human rhinovirus have a strong seasonal pattern with outbreak occurring during wintertime and almost no activity during summer.
Figur 6. (Sundell et al 2016). Weekly incidence of various respiratory pathogens, detected with real-time PCR, according to season across three consecutive years 20102013 (n = 8006). All agents except human rhinovirus have a strong seasonal pattern with outbreak occurring during wintertime and almost no activity during summer.
 Figur 7 (Sundell et al 2016). Weekly incidence (number of cases/week) of influenza A (IFA) virus infections (grey bars) according to average weekly outdoor temperature (degrees Celsius; solid black line), vapor pressure (VP (hPa); dotted black line) and relative humidity (RH (%); squared black line) across the entire study period (October 2010July 2013).
Figur 7 (Sundell et al 2016). Weekly incidence (number of cases/week) of influenza A (IFA) virus infections (grey bars) according to average weekly outdoor temperature (degrees Celsius; solid black line), vapor pressure (VP (hPa); dotted black line) and relative humidity (RH (%); squared black line) across the entire study period (October 2010July 2013).
 Figur 8 (Sundell et al 2016). Cumulative weekly incidence of influenza A (IFA) virus infections (number of cases per week; grey bars) according to average weekly outdoor temperature (degrees Celsius; solid grey line) and vapor pressure (dotted black line) during each of the three seasonal IFA outbreaks that occurred during the study period, separately.
Veien videre
Sykehusene anses som verstingen med hensyn til «tørr luft» med jevnt over svært høye ventilasjonsrater og for høye lufttemperaturer kombinert med dels opphopning av svært sårbare pasientgrupper.
Det foreslås å befukte opp til 30-40% RF for å forebygge influensasmitte (både økt smitteevne, virulens og mottakelighet hos sårbare grupper) både i vitenskapelig litteratur (Arundel et al 1985, Shaman & Kohn 2009, Davis et al 2012, Metz et al 2015) og av leverandører av befuktingsinstallasjoner. Dette blir brukt for det det er verdt i markedsføringen av «gode løsninger». Ulempene er at:
Figur 8 (Sundell et al 2016). Cumulative weekly incidence of influenza A (IFA) virus infections (number of cases per week; grey bars) according to average weekly outdoor temperature (degrees Celsius; solid grey line) and vapor pressure (dotted black line) during each of the three seasonal IFA outbreaks that occurred during the study period, separately.
Veien videre
Sykehusene anses som verstingen med hensyn til «tørr luft» med jevnt over svært høye ventilasjonsrater og for høye lufttemperaturer kombinert med dels opphopning av svært sårbare pasientgrupper.
Det foreslås å befukte opp til 30-40% RF for å forebygge influensasmitte (både økt smitteevne, virulens og mottakelighet hos sårbare grupper) både i vitenskapelig litteratur (Arundel et al 1985, Shaman & Kohn 2009, Davis et al 2012, Metz et al 2015) og av leverandører av befuktingsinstallasjoner. Dette blir brukt for det det er verdt i markedsføringen av «gode løsninger». Ulempene er at:
- Befukting er krevende og introduserer nye potensielle risker både for pasienter, ansatte, bygg og installasjoner.
- Befukting i stor utstrekning vil kreve dels betydelig økt energiforbruk
- Utetemperaturjusterte temperatur- og ventilasjonskrav. I første omgang også effekter av nye ventilasjonskrav fra EU i Health Vent (Carrer et al 2018)
- Lavere lufthastigheter ned mot 0,05 m/s i oppvarmingssesongen. Økende lufthastigheter 0,07 0,15 m/s gir ikke opplevelse av «trekk», men av redusert temperatur (Bakke et al. Indoor Air 2008; 18: 131-143).
- Befuktning når helt nødvendig, kun der det trengs og med den mengden som er nødvendig. Det trengs eventuelt «idiotsikre» installasjoner som er lett å drifte.
- Grundige tverr- og flerfaglige risikovurderinger og kartlegging av forskningsbehov
- Implementering og evaluering av kunnskapsbaserte tiltak og løsninger
- Etablering og finansiering av tverr og flerfaglig kunnskapsutvikling, forskning og evaluering av tiltak.
- Byggforsk/ Best Vent/ Oslo Met
- Folkehelseinstituttet, (inneklima og helse, smittevern, virus)
- Bygg og Eiendom i Helse Sør-Øst
- Avdeling for smittevern i Helse Sør-Øst
- Diakonhjemmet v/ Carsten F. Rønning, Eiendomsavdelingen

![Heidenreich Logo[1]](https://img1.custompublish.com/getfile.php/5110520.2971.squulbbubjsqim/0x70/6486797_5110520.jpg)


